如何在实验室里制作浓硫酸(23硫酸的制备和性质知识点)
23硫酸的制备和性质知识点
一、硫酸的制备
工业上接触法制硫酸的主要设备及生产流程如下图:
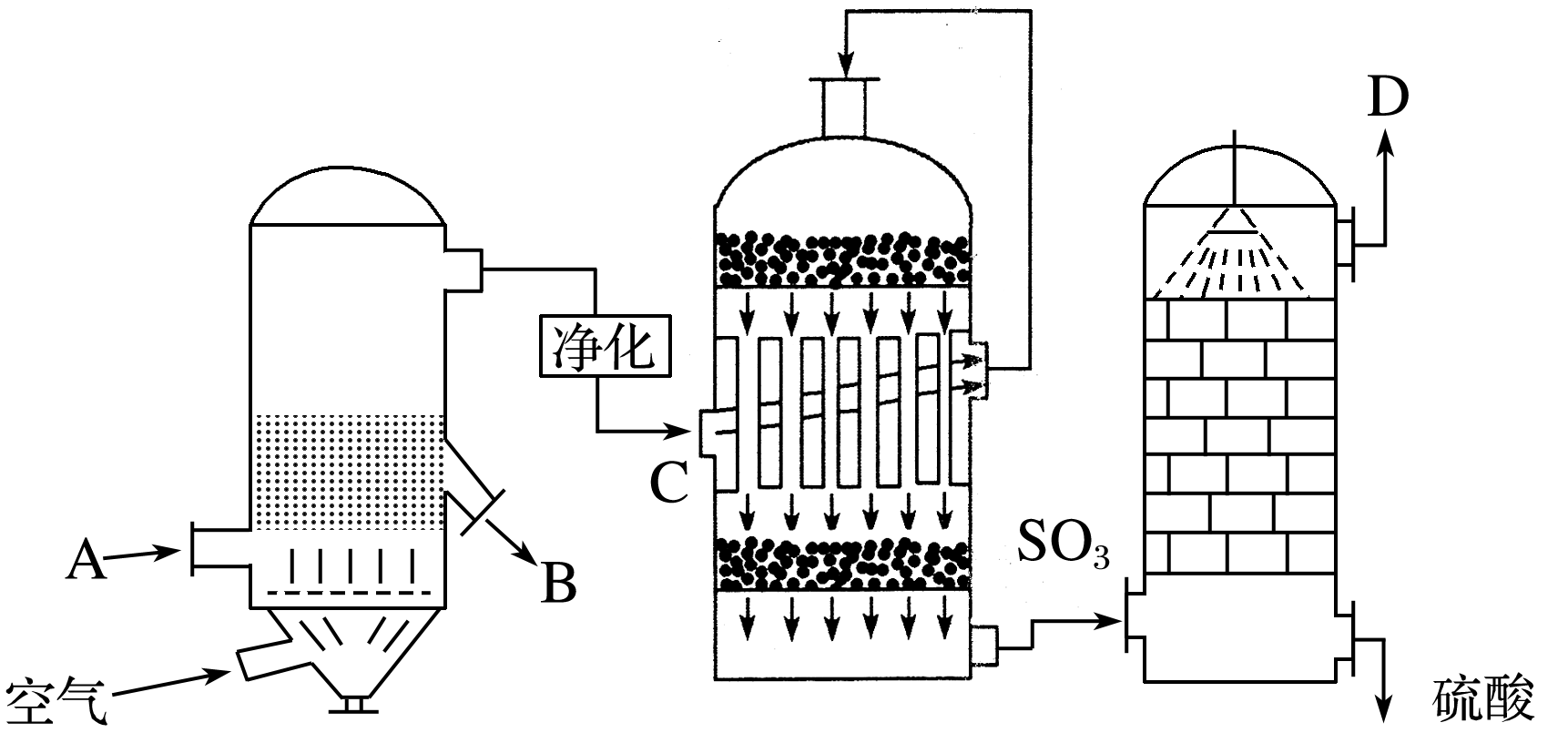
根据上图回答下列问题:
(1)填写下列各进口或出口物质的名称:
A含硫矿石(如FeS2);B炉渣;C二氧化硫、氧气;D尾气(SO2、O2)。
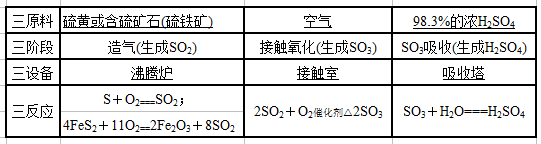
(2)接触法制硫酸分为三个阶段,填写下表:
工业制硫酸的注意事项
(1)在沸腾炉中煅烧黄铁矿时,要把矿石粉碎,目的是增大黄铁矿与O2的接触面积,使反应加快,提高原料利用率。
(2)炉气进入接触室前要净化,目的是除去炉气中的杂质,防止催化剂中毒及对设备造成不利影响。
(3)接触室内使用热交换器的目的是利用SO2和O2反应放出的热量预热输入设备的气体,冷却反应后的气体。
(4)在吸收塔内用98.3%的浓H2SO4吸收SO3而不是用水吸收的原因是用水吸收SO3时,易形成酸雾,吸收速率慢,而用98.3%的浓H2SO4吸收SO3时,吸收SO3的速率快,不形成酸雾,吸收完全。
二、浓硫酸的特性
1.吸水性
(1)浓硫酸可吸收空气或其他气体中的水蒸气、混在固体中的湿存水、结晶水合物中的结晶水。
(2)常用盛有浓硫酸的洗气瓶干燥某些气体(如H2、Cl2、SO2等),不能干燥碱性气体(如NH3等)和强还原性气体(如H2S等)。
2.脱水性
(1)浓硫酸可使有机化合物中的氢、氧元素按水的组成从有机物中"脱离"出来,结合生成水分子。
(2)浓硫酸脱水性实验如图所示:
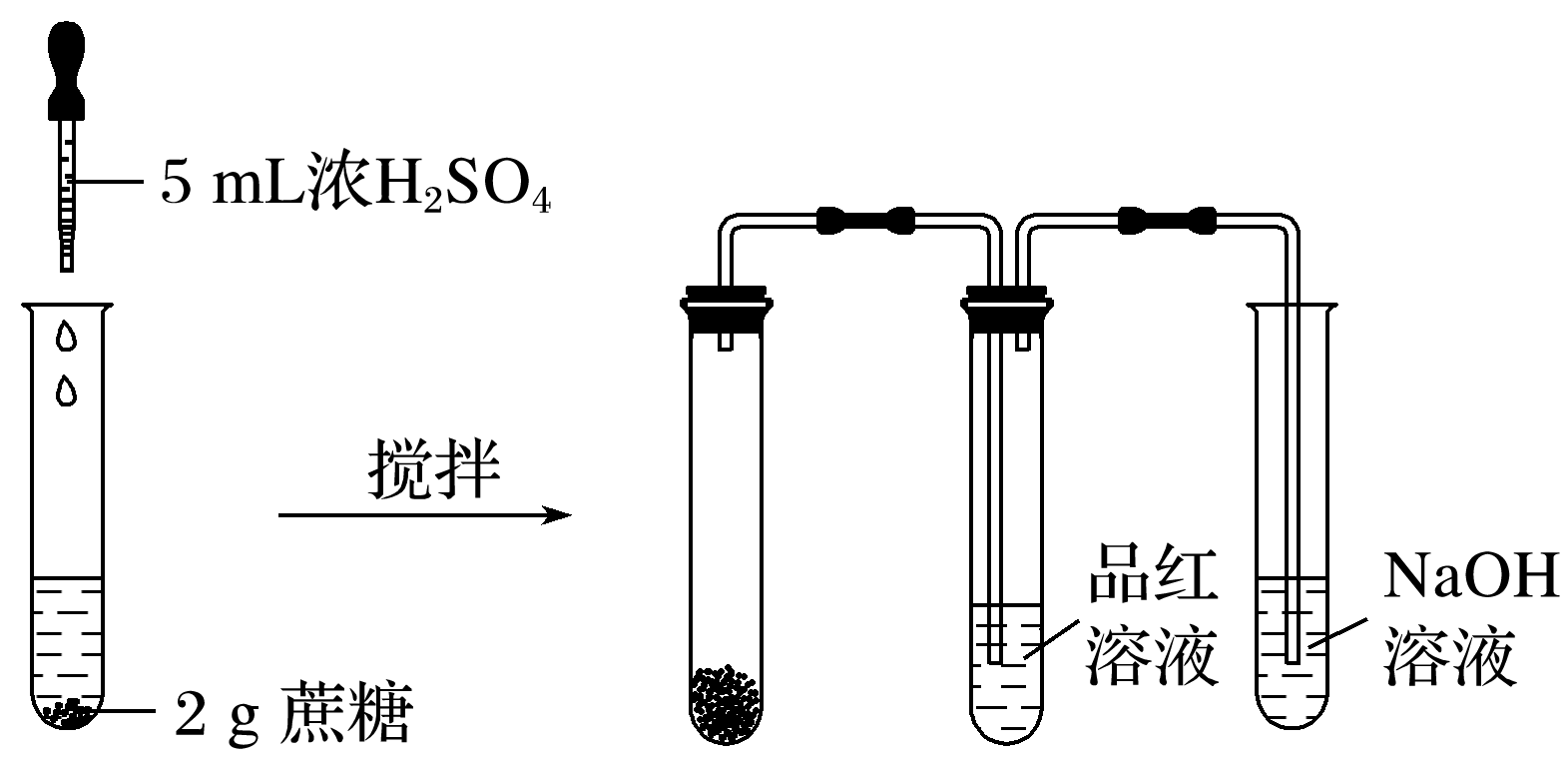
①现象:蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状固体,放出有刺激性气味的气体,品红溶液褪色。
②结论:浓硫酸具有脱水性,且能氧化碳单质,同时自身被还原为二氧化硫。
3.强氧化性
(1)与金属铜的反应
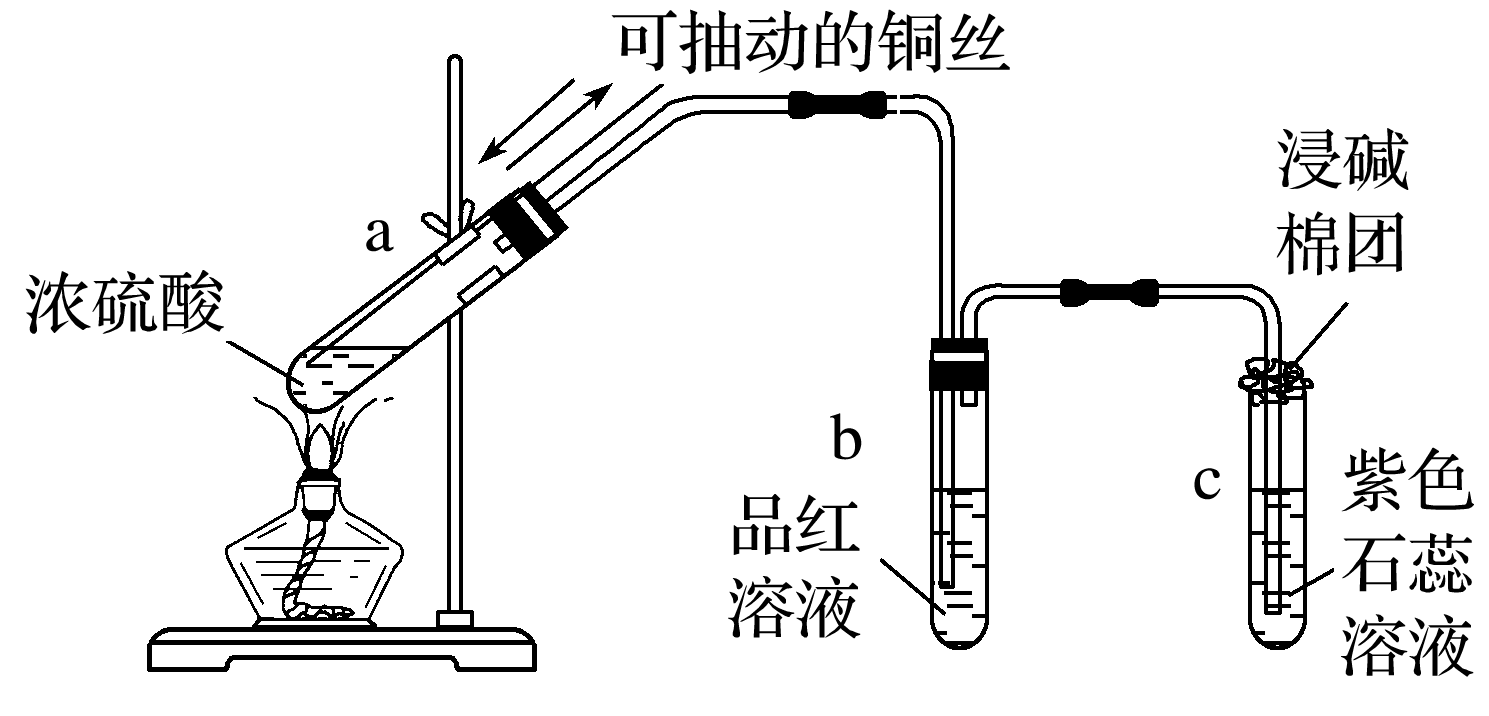
①实验现象:
a试管中铜丝表面变黑,有气泡逸出;
b试管中的品红溶液逐渐变为无色;
c试管中的紫色石蕊溶液逐渐变为红色;
冷却后,将a试管里的溶液慢慢倒入水中,溶液变为蓝色。
②铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)==(△))CuSO4+SO2↑+2H2O。
(2)与铁、铝的反应
常温下,铁、铝表面被浓硫酸氧化为致密的氧化膜而钝化,从而阻止了酸与内层金属的进一步反应,所以常温下可以用铁、铝制容器来盛装浓硫酸。
(3)与非金属的反应
浓硫酸与木炭反应的化学方程式:
C+2H2SO4(浓)==(△))CO2↑+2SO2↑+2H2O。
浓硫酸的强氧化性
(1)浓硫酸能与大多数金属反应,生成高价态金属的硫酸盐,本身一般被还原为SO2。但在常温下,浓硫酸能使铁、铝钝化。
(2)浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸,本身被还原为SO2。
三、几种重要的硫酸盐及其用途
1.硫酸钙
(1)化学式:生石膏CaSO4·2H2O,熟石膏2CaSO4·H2O。
(2)熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏。
(3)石膏常用于制作各种模型和医疗上用的石膏绷带。在水泥生产中,可用石膏调节水泥的凝结时间。
2.硫酸钡
(1)硫酸钡不容易被X射线透过,在医疗上可用作检查肠胃的内服药剂,俗称"钡餐"。
(2)硫酸钡可用作白色颜料,并可作高档油漆、油墨、造纸、塑料、橡胶的原料及填充剂。
3.硫酸亚铁
(1)硫酸亚铁的结晶水合物俗称绿矾,其化学式为FeSO4·7H2O。
(2)在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂。
(3)在工业上它还是生产铁系列净水剂和颜料氧化铁红的原料。
本文链接:http://www.xmwpz.cn/sh/3113.html
版权声明:本文内容由互联网用户自行发布,该文观点仅代表作者本人。本站仅提供信息存储空间服务,不拥有所有权,不承担相关法律责任。如发现本站有涉嫌抄袭侵权/违法违规的内容, 请联系qq:1442716096举报,一经查实,本站将立刻删除。

